创新药大事件:两款国产新冠药物获批上市!疗效显著不输辉瑞Paxlovid!
近日,两款备受关注的国产新冠治疗药物双双获批上市。先声药业29日发布公告称集团与中国科学院上海药物研究所、武汉病毒研究所合作的创新药先诺欣®(先诺特韦片╱利托那韦片组合包装)由中国国家药品监督管理局按照药品特别审批程序应急审评审批,附条件批准在中国上市,用于治疗轻中度新型冠状病毒感染的成年患者。
30日早间,君实生物发布公告称控股子公司上海旺实生物医药科技有限公司(以下简称“旺实生物”)申报的口服核苷类抗新型冠状病毒1类创新药民得维®(VV116)上市,用于治疗轻中度新型冠状病毒感染的成年患者。
两则消息一出立即引发业界人士的广泛关注,原因无他,在Paxlovid无缘医保之后,国产新冠治疗药物的需求日益迫切。然而,尽管国内布局新冠治疗药物的企业众多,但预期疗效能够与红极一时的“P药”比肩并跑的管线实为罕见。
而从临床数据来看,先诺欣®与民得维®均具有不俗的疗效,尤其是相比Paxlovid而言具有一定程度的比较优势,因此也被视为国产新冠药物的种子品种。那么,两款国产新冠药物与Paxlovid究竟有何异同,临床疗效究竟何者更优呢?
先诺欣®:以症状恢复时间为主要终点 相比P药具有差异化优势
从治疗机制来看,目前新冠口服药包括RdRp抑制剂、3CL蛋白酶抑制剂、JAK1抑制剂、AR拮抗剂等多种作用机制。其中,以默沙东莫奈拉韦为代表的RdRp抑制剂和以Paxlovid为代表的3CL蛋白酶抑制剂是当下的主流选择。
Paxlovid 作为国际普遍采用的新冠治疗药物,其真实世界研究让 3CL药物在真实世界中的良好疗效和安全性得到全方位验证,而先诺欣®作为国产首款具备自主知识产权并成功上市的 3CL蛋白酶抑制剂,填补了国内口服新冠药物的空白,具有显著的先发优势。
那么相比于成名已久的P药,先诺欣®有什么优势呢?直接说结论,两种药物各有千秋。从临床试验主要终点来看,先诺欣®III期临床研究采用11个症状的持续恢复为主要终点,包括咳嗽、鼻塞流涕、咽痛、呼吸困难、头痛、发热、寒战等。
而P药的主要终点则为住院及死亡患者比例。简而言之,先诺欣®目前已论证的主要功效是使中轻度患者更快地康复,而P药则是更加聚焦于降低具备重症高风险因素患者的住院或死亡的风险。
从疗效来看,先诺欣®的确实现了缩短中轻度患者康复周期的功效。临床数据显示,先诺欣组与安慰剂组相比,11种相关症状首次用药至症状完全消除时间可显著缩短约1.5天,其中重症高风险人群亚组显著缩短约2.4天。核酸转阴时间显著缩短约2.2天,同时数据提示尽早使用疗效更优。
值得一提的是,就“病毒载量下降”这一结果而言,在接受完整的5天疗程治疗后,先诺欣®组病毒载量显著下降约96%,而Paxlovid则是下降了86.4%,先诺欣超过后者近10个百分点,这也进一步论证了先诺欣®的有效性。
此外,从临床设计来看,先诺欣Ⅱ/Ⅲ期临床研究均纳入大样本中国患者,且针对目前正在流行的奥密克戎毒株。而P药Ⅲ期临床研究未纳入中国患者,入组患者均为德尔塔毒株,先诺欣®对目前国内的新冠病毒更具针对性。
从整体上看,先诺欣®的成功研制为我国患者提供了新的治疗选择,同时更加具有针对性,临床价值显著。至于人们乐于探讨的与P药何者更优,上市公司研究院认为从临床试验设计的主要终点、临床试验入组患者及针对的病毒株来看,二者治疗目标并不完全一致,具有一定差异性,因此讨论何者更优意义不大。
在药物可及性方面,近日先声药业在官网发布的关于“新冠口服药扩建项目环境影响评价公众参与第一次公示”中提及,预计生产规模为新冠原料药 200 公斤/年,新冠口服药 3.2 亿片/年。同时先声药业通过媒体表示,先诺欣®获批上市后将立即投产,初期优先保供中国疫情严重地区,该药物定价将大幅低于同靶点药物辉瑞Paxlovid。
随着变异株致病力的衰减,以及结合我国疫情高峰已过,且暂未出现新一轮感染高峰的形势来看,未来新冠治疗的重心或将由重症逐步向中轻症转移,因而先诺欣®未来的市场价值值得期待,有望凭借先发优势及产能、成本优势迅速放量,造福国内患者。
民得维®:头对头试验不输Paxlovid 不良事件发生率更低
如果问国内哪款新冠口服药与P药功效最为接近,那么一定是在与P药头对头实验中达到非劣的民得维®(VV116)。
民得维®是一款由君实生物控股子公司上海君拓生物医药科技有限公司(以下简称“君拓生物”)与苏州旺山旺水生物医药有限公司(以下简称“旺山旺水”)合作开发的口服核苷类抗新型冠状病毒1类创新药物。
此前,在君实生物曾于2023年1月2日公布民得维®与Paxlovid的“头对头”III期临床研究结果。所谓“头对头”,就是将试验药物和有效药物进行直接比较,而不是通过跟安慰剂对比,来评估药物的疗效和安全性。同时,该方案设计同样主要选择有高危因素的、有可能进展的轻度和中度的新冠成人患者。
研究结果显示,VV116与PAXLOVID在“至持续临床恢复的时间”达到非劣效,VV116组和Paxlovid组在“至持续症状消失的时间”、“至首次新型冠状病毒核酸阴性时间”方面表现类似,中位时间均为7天。在每一个预设时间点(第5、7、10、14、28天),VV116组症状缓解的患者比例均高于Paxlovid组。
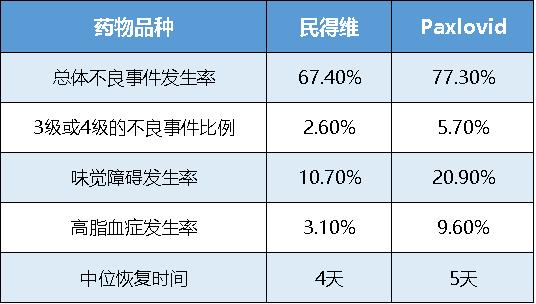
从安全分析的结果看,VV116总体不良事件发生率比Paxlovid低,VV116是67.4%,而Paxlovid是77.3%。3级或4级的不良事件比例VV116是2.6%,Paxlovid是5.7%。发生率大于5%的不良事件主要包括味觉障碍、高甘油三酯血症和高脂血症。
两组之间对比结果为,味觉障碍VV116和Paxlovid发生率分别为3.6%、25.8%;高甘油三酯血症发生率分别是10.7%、20.9%;高脂血症发生率分别是3.1%、9.6%。不良事件在随访中都有改善或者消退。总体而言,VV116和Paxlovid在药物安全性方面均表现良好,且VV116更优。
资料来源:公开资料 上市公司研究院整理
此外,由于Paxlovid是两种药物的复合成分,有两片的奈玛特韦和一片的利托那韦。奈玛特韦主要发挥抗新冠病毒作用,而利托那韦在一些有合并用药的受试者或者病人里面能增加其他合并用药的疗效,所以限制了适用人群,比如心脑血管疾病、代谢性疾病,有些药物不能随便停用,这限制了Paxlovid的应用。而VV116没有包含利托那韦成分,目前研究来看还没有发现这方面的顾虑。
总体而言,VV116的研究结果基本上证实了药物的疗效和安全,为临床上治疗新冠提供了新产品和新手段。除国内获批上市外,VV116还于2021年在乌兹别克斯坦获批用于治疗中度和重度的新冠患者。
写在最后
目前国内已获批上市的新冠治疗药物包括Paxlovid、莫奈拉韦、阿兹夫定、先诺欣、民得维,上市国产新冠药物品种数量超越进口达到3种。国产新药的强势崛起一方面进一步完善了国内新冠治疗领域存在的不足,另一方面也是我国医药生物产业创新发展取得重要成果的体现,期待未来能够有更多针对未满足临床需求的国产创新药物问世,造福中国乃至世界患者。





- 银行股迎来“黄金买点”?摩根大通预计下半年潜在涨幅高达15%,股息率4.3%成“香饽饽”
- 华润电力光伏组件开标均价提升,产业链涨价传导顺利景气度望修复
- 我国卫星互联网组网速度加快,发射间隔从早期1-2个月显著缩短至近期的3-5天
- 光伏胶膜部分企业上调报价,成本增加叠加供需改善涨价空间望打开
- 广东研究通过政府投资基金支持商业航天发展,助力商业航天快速发展
- 折叠屏手机正逐步从高端市场向主流消费群体渗透
- 创历史季度新高!二季度全球DRAM市场规模环比增长20%
- 重磅!上海加速推进AI+机器人应用,全国人形机器人运动会盛大开幕,机器人板块持续爆发!
- 重磅利好!个人养老金新增三大领取条件,开启多元化养老新时代,银行理财产品收益喜人!
- 重磅突破!我国卫星互联网组网速度创新高,广东打造太空旅游等多领域应用场景,商业航天迎来黄金发展期!




